Rutherford Atom Modeli, Yeni Zelandalı fizikçi Ernest Rutherford tarafından, atomun yapısını açıklamak üzere öne sürülmüş bir atom modelidir. Tıpkı gezegenlerin Güneş etrafındaki dönüşü gibi, elektronların da atom çekirdeği etrafında döndüğünü ileri süren Rutherford Atom Modeli, “gezegen atom modeli” ya da “Güneş Sistemi Atom Modeli” olarak da bilinmektedir.
Rutherford’un 20.yüzyılın başında atomun yapısına ilişkin ortaya attığı bu model, atomun kütle ve yükünün oldukça küçük bir hacimde, bir diğer ifadeyle atomun çekirdeğinde yer aldığı, geri kalan bölgelerin de boşluktan ibaret olduğunu ifade eder.
Rutherford Atom Modeli’nden önce tarihte birçok kişi tarafından çeşitli atom modelleri ortaya atılmıştı.
Atom kavramının ilk kez literatüre girmesi Milattan önce 400 yılında, ünlü Yunan filozofu Demokritus’un atom fikrini ilk defa ortaya attığı zaman gerçekleştiğini söyleyebiliriz.
Fakat Demokritos’un atom modeli, dönemin çevrelerince pek kabul görmemişti ve sonraki uzun yıllar boyunca da bu atom modeline pek itibar gösterilmeyecekti.
Öte yandan Demokritus sadece öngörü ve tahmin gücüne dayanarak, tamamen teorik bir biçimde atom kavramını ileri sürmüştü. Atomun varlığının deneysel olarak gösterilebileceğinin anlaşılması için ise yaklaşık 2000 yılın geçmesi gerekiyordu.
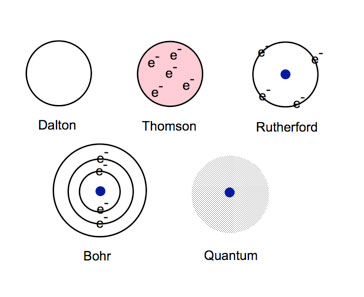
Nitekim 1803 yılında John Dalton, bazı deney ve gözlemlere dayanarak Demokritos’tan neredeyse 2000 yıl sonra tekrar atom kavramını bilim camiasına sokmayı başarmıştı. Ancak Dalton Atom Modeli olarak bilinen bu modelin de kusurları bulunuyordu.
Örneğin Dalton, atomların bölünemez bir yapıda olduğunu iddia etmekteydi. Atomun bölünemez bir nitelikte olduğunu söyleyen bu model, İngiliz fizikçi J.J.Thomson’un negatif yüke sahip olan elektronu keşfettiği zaman geçerliliğini tamamen yitirecekti.
Thomson, elektronların pozitif yüklü bir “kalıp” içinde düzenli bir şekilde dağıldığı yeni bir atom modeli öne sürmüştü. Bu model “üzümlü kek modeli” olarak da bilinmektedir. Buradaki kek, atomun kendisini temsil ederken üzerindeki üzümler de elektronları temsil etmekteydi.
Ancak Thomson’un üzümlü kek atom modeli de bazı açıklanamayan hususlara ve hatalara sahipti. Örneğin bu model, elektronların atom içindeki konumlarını yanlış bir şekilde açıklıyordu.
Rutherford Atom Modeli Hangi Deneyle Ortaya Çıkmıştır?
Bunun üzerine Yeni Zelandalı fizikçi Ernest Rutherford, Altın Folyo Deneyi olarak bilinen 1911 tarihli ünlü deneyinde, atomun çok küçük ve “ağır” bir çekirdeği olduğunu göstererek Thomson’un modelini alaşağı edecekti.
Rutherford yaptığı bu deneyde alfa parçacığı olarak bilinen radyoaktif bir element kullanarak, atomun gözle görülmeyen yapısını ortaya çıkarmıştır.
Deneyde kullanılacak olan alfa parçacıkları, pozitif yüklü ve radyoaktif parçacıklar olup hidrojen atomunun yaklaşık dört katı bir kütleye sahiptir. Ayrıca elektrondan da yaklaşık 7000 kat daha ağırdır.
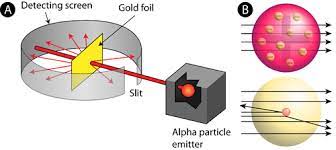
Rutherford’un gerçekleştirdiği altın folyo deneyinde alfa parçacıklarından oluşan radyoaktif elementler, folyonun etrafında sarılı olan floresan bir ekranın aralığından geçmektedir.
Gönderilen her bir alfa parçacığı floresan ekranını vurdukça, bir ışık parıldaması ortaya çıkıyordu. Rutherford bu ışıldamayı ekranın arkasına yerleştirdiği bir mikroskop aracılığıyla görebiliyordu. Peki bu ışıldama ne anlama gelmekteydi?
Rutherford’un Deneye İlişkin Gözlem ve Çıkarımları
O dönemde kabul edilen Thomson Atom Modeli’ne göre bir atomun kütle ve yükünün, atom içinde düzenli bir şekilde dağılmış olması gerekiyordu. Böylelikle Rutherford’un yaptığı deneyin sonucunda bilim insanları, neredeyse bütün alfa parçacıklarının hiç sekmeden altın folyonun içinden geçmesi gerektiğini düşünüyordu.
Ancak deneyde şaşırtıcı bir şekilde alfa parçacıklarının çok küçük bir kısmı, farklı açılarda altın folyodan sekmişti. Bu yüzden Rutherford, folyonun etrafına yerleştirdiği ekranda birtakım parıldamalar görmüştü. Çünkü bu parıldamalar, gönderdiği alfa parçacıklarının ekrana sekmesiyle oluşmaktaydı.
Hatta bazı parçacıklar doğrudan geriye, geldiği yöne doğru sekmişti. Çok şaşırmış olacak ki Rutherford bile bu gözlemi şu şekilde açıklıyordu:
Sanki 40 cm çapında bir top güllesini kağıt bir mendile doğru fırlatmışsınız ve mendilden geri sekerek sizi vurmuş.
Bunun üzerine Rutherford’un, yaptığı deneyin sonuçlarını açıklamak üzere tamamen yeni bir atom modeli ortaya atması gerekiyordu. Alfa parçacıklarının büyük çoğunluğu altın folyonun içinden geçtiğine göre o zaman atomun büyük bir kısmının sadece boşluktan ibaret olması gerektiğini düşündü.
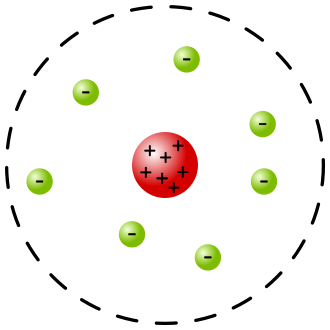
Görsel: Rutherford Atom Modeli. Atomun merkezinde pozitif yüklü bir çekirdek bulunur. Etrafında da negatif yüklü elektronlar “dönmektedir”.
Öte yandan farklı açılarda sapan alfa parçacıkları ise atomun içinde var olan muazzam bir karşı kuvvetle karşılaşmış olmalıydı.
Alfa parçacıkları pozitif yüklü olduğundan atomun içinde her ne varsa onun da pozitif bir yükü olması gerektiği çıkarımını yapan Rutherford, bunun üzerine atomun merkezinde pozitif yüklü bir çekirdeğin var olduğunu ileri sürdü.
Rutherford Atom Modeli olarak adlandırılan bu modele göre atomun merkezinde çekirdek isimli, pozitif yüklü bir yapı bulunmaktadır. Atomun neredeyse bütün kütlesi de bu çekirdeğin içinde mevcut olup çekirdeğin etrafında ise negatif yüklü elektronlar dönmektedir.
Rutherford, 1911 yılının Mayıs ayında yayımladığı makalede “çekirdek” ifadesini kullanmayıp, pozitif yüklü küçük, merkezi bir bölgeden bahsediyordu:
Somut olarak ifade etmek gerekirse, yüksek hızlı bir alfa parçacığının, pozitif yüke sahip bir atomun içinden geçtiğini ve bu atomun da negatif yüklü elektronlarla çevrili olduğunu düşünün.
Rutherford Atom Modeli Neye Benzer?
Rutherford yaptığı gözlemler sonucu atoma ilişkin şu sonuçlara varmıştı:
- Altın folyoya doğru gönderilen alfa parçacıklarının büyük bir kısmı, herhangi bir sapma olmadan folyonun içinden geçmiştir. Böylelikle bir atomun içi çoğunlukla boş bir yapıdadır.
- Alfa parçacıklarının bazısı çok küçük açılarla altın folyo tarafından saptırılmıştır. Bu nedenle altın atomlarının içindeki pozitif yük düzgün bir şekilde dağılım göstermemektedir. Pozitif yük, çok küçük bir hacim içinde bulunmaktadır.
- Alfa parçacıklarının çok az kısmı, geldiği yöne geri sekmiştir. Böylelikle atomun içindeki pozitif yüklü parçacığın(çekirdeğin) işgal ettiği alan, atomun toplam hacmine kıyasla oldukça küçüktür.
Rutherford Atom Modeli, atomun yükünü ve kütlesini oldukça küçük bir çekirdeğin oluşturduğunu söylemekteydi. Fakat Rutherford, geriye kalan atom kütlesini ve elektronları hesaba katacak bir model ortaya koymamıştı.
Yazdığı makalede atomun merkezindeki pozitif yüklü çekirdeğin, atom kütlesine orantılı olabileceğini öne sürüyordu. Gerçekleştirdiği deneydeki altın folyo açısından altın atomunun kütle numarası 197 olduğu için Rutherford, altın atomunun yükünün 98 olabileceğini ifade etmekteydi.
Rutherford Atom Modeli Özellikleri
Rutherford Atom Modeli hakkında bilinmesi gereken temel özellikler şunlardır:
- Atomun merkezinde, son derece küçük bir hacimde pozitif yüklü parçacıklar bulunmaktadır. Rutherford bu son derece küçük bölgeyi atom çekirdeği olarak isimlendirdi.
- Rutherford Atom Modeli negatif yüklü elektronların atom çekirdeğinin etrafında bulunduğunu öne sürüyordu. Ayrıca çekirdeği çevreleyen bu elektronların, dairesel yörüngeler halinde çok yüksek hızlarda döndüğünü iddia etmişti.
- Negatif yüklü elektronlar ve atomun çekirdeğinde bulunan son derece yoğun haldeki pozitif yüklü parçacıklar, güçlü elektrostatik kuvvet tarafından bir arada tutulmaktaydı.
Rutherford Atom Modeli bundan sonra “çekirdek atom modeli” olarak da bilinir olmuştur.
Bu noktada çekirdeğin, atomun geri kalanına kıyasla ne kadar küçük olduğunu belirtmekte fayda olduğunu söyleyebiliriz. Örneğin atomun boyutunu bir futbol sahası kadar büyütürsek, atom çekirdeği bu ölçeğe göre sadece bir bilye büyüklüğünde olacaktır.
İşte atom ile atomun çekirdeği arasındaki fark bu kadar fazladır. Buradan da atomun aslında büyük bir çoğunluğunun boşluktan meydana geldiğini ifade edebiliriz.
Rutherford Atom Modeli Eksiklikleri
Her ne kadar Rutherford Atom Modeli deney ve gözleme dayanarak ortaya atılmış bir model olsa da bu model de atomun yapısına ilişkin belli başlı özellikleri açıklamakta başarısız olmaktadır.
Örneğin Rutherford, elektronların çekirdek etrafında, yörüngeler dediği sabit dairesel yollar içinde döndüğünü öne sürmüştü. Ancak James Clerk Maxwell’a göre ivmelenen yüklü parçacıklar elektromanyetik radyasyon yayarlar ve bu nedenle çekirdek etrafında dönen bir elektron da elektromanyetik radyasyon yaymalıdır.
Ancak yaydığı radyasyon, elektrondan çıktığı için enerjisini azaltacak ve böylece elektronun yörüngesinin küçülmesine yol açacaktır. Bunun sonucu olarak da elektronlar önünde sonunda çekirdeğe “düşecektir”.
Yapılan araştırmalara göre bir elektron, Rutherford Atom Modeli’nin dediği gibi çekirdek etrafında dönseydi 10 üzeri eksi 8 saniye içinde çekirdeğe düşerdi. Ancak görülebileceği üzere elektronlar yörüngelerinde “dolanmaya” devam ediyor ve çekirdeğe düşmeyerek atomun yapısı da korunmuş oluyor.
Çok açık bir şekilde görüleceği üzere Rutherford Atom Modeli atomun neden hala kararlı bir yapıda olduğunu açıklayamamaktadır.
Eksikliklerine rağmen Rutherford Atom Modeli, ondan sonra gelecek olan kuantum fiziği alanındaki gelişmeler için bir öncü model olacaktır.
Rutherford Atom Modeli’nde Elektronlar
Rutherford Atom Modeli, elektronların adeta bir kekin içindeki üzümler gibi pozitif yüklü atomun içinde gömülü olduğunu söyleyen Thomson Atom Modeli’nin yerini almıştı.
Rutherford’un modelinde elektronlar, tıpkı gezegenlerin Güneş etrafında dönmesi gibi atom çekirdeğinin etrafında dönüyor şeklinde tasvir edilmişti. Bu yüzden Rutherford Atom Modeli, gezegen atom modeli olarak da bilinmektedir.
Fakat Rutherford Atom Modeli, atomun iç yapısına yönelik anlayışımızın gelişmesinde bilim tarihinde çok önemli bir rol oynasa da elektronların doğasına ilişkin tamamen doğru bir açıklama sunamamaktadır.
Çünkü Rutherford Atom Modeli daha çok klasik fiziğe dayanan bir modeldi. Atom altı parçacıkların çalışma prensibine yönelik daha doğru açıklamaların, sonraki yıllarda Bohr Atom Modeli gibi kuantum fiziğine dayanan modeller tarafından getirildiğini söyleyebiliriz.
Ancak yine de Rutherford Atom Modeli günümüzde sahip olduğumuz atom anlayışının oluşmasında kritik bir rol oynamaktadır.
Kaynaklar:
1- Britannica, “Rutherford model”. <https://www.britannica.com/science/Rutherford-model>. (Erişim Tarihi: 9 Eylül 2021).
2- Byjus, “Rutherford Atomic Model and Limitations”. <https://byjus.com/chemistry/rutherfords-model-of-atoms-and-its-limitations/>. (Erişim Tarihi: 9 Eylül 2021).
3- Lumen Learning, “Rutherford’s Atomic Model”. <https://courses.lumenlearning.com/cheminter/chapter/rutherfords-atomic-model/>. (Erişim Tarihi: 9 Eylül 2021).
4- Toppr, “Rutherford’s Model of An Atom”. <https://www.toppr.com/guides/chemistry/structure-of-atom/rutherfords-model-of-an-atom/>. (Erişim Tarihi: 9 Eylül 2021).