Thomson Atom Modeli, elektronun keşfedilmesinden sonra Britanyalı fizikçi Joseph John Thomson(1856-1940) tarafından ortaya atılmış bir atom modelidir.
Thomson Atom Modeli, tarihteki ne ilk ne de son atom modeli olmuştur. J.J.Thomson’ın yeni bir atom modeli geliştirme ihtiyacı duymasını sağlayan şey de birazdan bahsedeceğimiz üzere elektronun keşfedilmesi olacaktır.
Elektronun keşfiyle birlikte atomun yapısının da önceden sanıldığından farklı olduğu ve böylelikle yeni bir atom modelinin geliştirilmesi gerektiği ihtiyacı ortaya çıkacaktır.
J.J.Thomson’un elektronu keşfetmesiyle birlikte yepyeni bir atom modeli, Thomson Atom Modeli fizik ve kimya literatürüne girecek ve atom modellerine yönelik anlayışımızda önemli bir rol oynayacaktır.
Ancak Thomson Atom Modeli’ne geçmeden evvel, bundan önceki ortaya atılan atom modellerinden çok kısa da olsa bahsetmekte fayda var. Çünkü Thomson Atom Modeli, kendinden önce geliştirilmiş olan atom modellerinin üzerine inşa edilmiş bir atom modelidir.
Tarihteki Atom Modelleri
Elektronun keşfine gelmeden önce bilim insanları çeşitli atom modelleri öne sürmüştü. Tarihteki ilk atom modelinin, Milattan önce 5.yüzyılda Antik Yunan döneminde yaşamış ünlü filozof Democritus tarafından geliştirildiğini görmekteyiz.
Democritus, evrendeki bütün maddelerin küçük, bölünemez ve yok edilemez yapılardan oluştuğunu iddia ediyordu. Bu yapılara da “atom” ismini vermişti.

Böylelikle Antik Yunan devrinde, Democritus ve yanlıları tarafından yepyeni bir anlayış, atomcu bir anlayış ortaya çıkıyordu. Ancak atom kavramı, bilimsel bir konsept olmaktan bir hayli uzaktı.
Çünkü o dönemde ne Democritus ne de başka birisi atomun varlığını kanıtlayacak bilimsel araçlara ve yöntemlere sahip değildi. Böylelikle atom kavramının Antik Yunan devrinde bilimsel bir kavramdan ziyade daha çok felsefi bir konu olduğunu söyleyebiliriz.
Zaman geçtikçe maddenin atomlardan oluştuğuna yönelik bu alanda yapılan çalışmalarda da kayda değer ilerlemeler gerçekleşmeye başlamıştı.
19.yüzyıla gelindiğinde İngiliz fizikçi ve kimyager John Dalton, buhar basıncı ve gazlarla ilgili bir dizi deney yapıyordu. Deneyleri esnasında farklı gazların, sadece belirli oranlarda birbirine karıştığını fark eden Dalton, buradan gaz parçacıklarının atomlardan oluşması gerektiği çıkarımını yapmıştı.
Democritus, atomların varlığını sadece akıl yürütmeye dayanarak ortaya atarken John Dalton, yaptığı deneyler sonucu atomların var olması gerektiğini söylemekteydi. Bu yönüyle Dalton, atomun varlığını deneysel olarak ilk kanıtlamaya çalışan bilim insanı olmuştur diyebiliriz.
Ancak Dalton’un öne sürdüğü atom modeli, nihai atom modeli olmaktan çok uzaktı. 19.yüzyılın sonlarına doğru gelirken, artan bilgi birikimi ve gelişen teknoloji ile birlikte bilim insanları, atomlardan daha küçük yapıların olup olmadığı sorusunu gündeme getirmeye başlamıştı.
Elektron Keşfediliyor
20.yüzyılın şafağında fizikçilerin zihninde önemli bir soru yer edinmişti: Elektriği ileten madde tam olarak neydi? Bu sorunun cevabını bulmak üzere, Katot Işın Tüpü isimli bir aletle deney yapmaya karar verdiler.
Bu ışın tüpünün içinde, her iki tarafında pozitif ve negatif yüklü olmak üzere 2 elektrot bulunur ve yüksek bir voltaj uygulanarak, negatif yüklü elektrottan pozitif yüklü olanına doğru bir ışın akımı gerçekleşir.
Bu deneyi yapanlardan birisi de Britanyalı fizikçi Joseph John Thomson idi. Thomson, deneye ek olarak pozitif ve negatif yüklü iki levhayı tüpün içine yerleştirmişti.
Ortaya çıkan ışınların negatif yüklü levhadan sapma göstererek pozitif yüklü levhaya doğru yöneldiğini fark eden Thomson, bu ışınların aslında negatif yüklü parçacıklardan oluştuğu kanısına vardı.
Çünkü aynı yüke sahip parçacıklar bilindiği üzere birbirini itme eğilimi gösterecektir.
İşte bu parçacıklar, sonradan elektron olarak adlandırılacaktı. Thomson, katot ışınlarının aslında negatif yüklü elektronlardan meydana geldiğini keşfetmişti.
Thomson, bu parçacıkların kütle ve yük oranlarını da hesaplayarak elektronların, hidrojenden yaklaşık 1000 kat daha küçük olduğunu ortaya çıkarınca, hidrojen atomundan daha küçük bir yapının var olduğu da ilk defa kanıtlanmış oluyordu.
Böylelikle de atomdan daha küçük, negatif yüklü bir atom altı parçacık olan elektron, tarihte ilk defa Thomson tarafından keşfedilmiş oldu.
Aynı zamanda tarih boyunca bilim insanları tarafından dile getirilen, atomun bölünemez bir yapıda olduğu görüşü de artık geçerliliğini yitirmek üzereydi. Thomson’a göre atom parçalanabilir bir yapıdaydı.
Thomson Atom Modeli Literatüre Giriyor
Buraya kadar olan durum şu şekildeydi: Maddenin en küçük yapıtaşı artık atom değildi. Atomdan çok daha küçük, öyle ki 1000 kat daha küçük, atom altı bir parçacık keşfedilmişti. Bu parçacık, negatif yüke sahip bir elektrondu.
Öte yandan atomdan daha küçük bir parçacık keşfedildiği için, atomun bölünemez nitelikte olduğu varsayımı da artık tarihin tozlu raflarını almak üzereydi.
Atomun keşfedilen bu yepyeni yapısını, yani hem pozitif hem de negatif yükten oluşan bu parçacığın yapısını açıklamak üzere bir model ortaya koymak gerekiyordu.
İşte bu noktada J.J.Thomson, negatif yüklü elektronların, pozitif yüklü atomun içinde düzgün bir şekilde dağılım gösterdiği bir atom modeli önermişti. Bu atom modeli Thomson Atom Modeli olarak bilinmektedir.
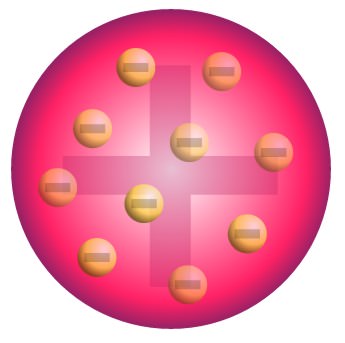
Thomson, atomdaki pozitif ve negatif yüklerin eşit oranlarda mevcut olduğunu öne sürerek, atomun tamamen nötr bir yapıda olduğunu ifade ediyordu.
Atomun küre şekilli olduğu inanışını sürdüren Thomson, negatif yüklü elektronların, pozitif yüklü atomun içinde bulunduğunu iddia etmişti.
Bir üzümlü kekteki üzümlerin elektron olduğunu, kekin tamamının da atomun kendisi olduğunu farz edersek, bu modelin neden aynı zamanda atomun Üzümlü Kek Modeli olarak adlandırıldığını da rahatlıkla anlayabiliriz.
Thomson Atom Modeli Özellikleri ve Varsayımları
Thomson Atom Modeli, daha önce de bahsedildiği gibi atoma ilişkin öne sürülen birçok modelden sadece bir tanesidir. Ancak Thomson Atom Modeli ortaya atıldığı dönemde, atomun çekirdeği henüz daha keşfedilmemişti.
Böylelikle Thomson, yaşadığı dönemde atoma ilişkin bilinen bütün bilgileri kullanarak Thomson Atom Modeli’ni ortaya atmıştı. Bu modelin özellikleri kısaca şu şekildedir:
- Atomun içinde, elektron isimli negatif yüklü parçacıklar mevcuttur.
- Bu negatif yüklü elektronlar, atomun içinde düzgün bir şekilde dağılım göstermektedir.
- Atomun kendisi pozitif olmakla birlikte, içinde negatif yüklü elektronlar barındırdığı için atom yük olarak nötr bir yapıdadır.
Thomson Atom Modeli, yapısı itibariyle bir üzümlü kekin yanı sıra bir karpuza da benzetilmektedir. Şöyle ki karpuzun içi olan kırmızı bölüm, pozitif yüke sahip olan atomun yapısına benzetilip, içinde bulunan çekirdekler de atomun içinde bulunan negatif yüklü elektronlara benzetilmektedir.
Hem üzümlü kek modelini hem de karpuz modelini aklımıza getirerek, Thomson’ın ortaya attığı atom modelinin böylelikle neye benzediğini daha kolay anlayabiliriz.
Thomson Atom Modeli Eksiklikleri ve Yanlışları
Thomson Atom Modeli yapılan deneylerle bir uyumluluk gösteredursun, sonradan yapılacak olan deneyler modele ilişkin birtakım problemler ortaya çıkaracaktı. Öncelikle, atomun pozitif bir yüke sahip olduğunu göstermeyle ilgili bir sorun vardı. Bu, literatürde “Thomson Problemi” olarak da bilinmektedir.
Genel olarak, Thomson Atom Modeli’nin eksiklikleri şunlardı:
- Atomun kararlı yapısını açıklamakta başarısız oluyordu. Çünkü Thomson Atom Modeli, pozitif bir yükün negatif yüklü elektronları atomun içinde nasıl tuttuğuna bir açıklama getiremiyordu.
- Thomson Atom Modeli, atomun çekirdeği hakkında herhangi bir şey söylemiyordu.
- Thomson Atom Modeli, Altın Folyo Deneyi olarak bilinen deneyde, alfa parçacıklarının altın folyodan sektiği gözlemini de açıklamakta yetersiz kalmaktaydı.
Thomson Atom Modeli’nin ortaya atılmasından sadece beş yıl sonra, Hans Geiger ve Ernest Marsden isimli bilim insanları, alfa parçacıklarını ve altın folyoyu kullanarak yapacakları deney sonucu bu atom modelini çürüteceklerdi.
Altın Folyo Deneyi olarak da bilinen bu deneyde alfa parçacıklarının, altın folyodan sekip florasan bir ekrandaki saçılım örneklerini ölçmeyi planlıyorlardı. Eğer Thomson Atom Modeli doğru olsaydı, alfa parçacıklarının altın folyo atomlarının içinden hiç sapmadan geçmesi gerekecekti.
Ancak deneyi yapanların gördüğü şey, alfa parçacıklarının büyük bir kısmının altın folyonun içinden geçerken, çok az bir kısmının farklı yönlerde saçılım göstermiş olmasıydı. Bir kısmı da parçacıkların çıktığı yöne doğru geri sekmişti.
Yeni Zelandalı fizikçi Ernest Rutherford da söz konusu olan deneyi yapmıştı ve bu deneyden bazı çıkarımları oldu. Alfa parçacıkları bilindiği üzere pozitif yüklü bir helyum çekirdeği olduğu için, alfa parçacıklarının kimisinin çeşitli yönlere doğru sekmesinin sadece bir sebebi olabilirdi: Atomun merkezinde yoğun bir halde, pozitif yüke sahip bir yapı olmalıydı.

Atomdaki pozitif yük, Thomson Atom Modeli’nin dediğinin aksine atom içinde düzenli bir dağılım göstermiyor, daha ziyade merkezde yoğunlaşıyordu. Buna ek olarak, folyonun içinden hiç sapmadan geçen parçacıkları gözlemleyen Rutherford, atomun içinin çoğunlukla boşluktan ibaret olması gerektiği çıkarımını yapmıştı.
Alfa parçacıklarının saçılım göstermesinin üzerine Rutherford, atomun merkezinde pozitif yüklü yoğun bir çekirdeğin olduğunu, bu pozitif çekirdeğin etrafında da elektronların döndüğünü öne sürmüştü. Rutherford’un öne sürdüğü bu model, Rutherford Atom Modeli olarak bilinmektedir.
Sonuç:
Her ne kadar Thomson Atom Modeli, atomun yapısını layıkıyla açıklayacak kadar doğru bir model olmasa da ondan sonraki atom modellerinin gelişiminde önemli bir rol oynayacaktır.
Thomson Atom Modeli, sadece elektronun keşfedilmesi gibi yeni keşifleri bünyesinde barındırmamış, ayrıca tarih boyunca insanların sahip olduğu, “bölünemez ve hareketsiz nitelikte olan atom” görüşünü ortadan kaldırarak atomun bölünebilir ve hareketli bir yapıda olduğunu göstermiştir.
Böylelikle Thomson’dan sonra gelen bilim insanları, atomun kendinden daha küçük parçacıklardan, proton ve nötron gibi atom altı parçacıklardan oluştuğunu ve aynı zamanda bu parçacıkları bir arada tutan güçlü nükleer kuvvet gibi atom altı kuvvetlerin varlığını keşfedeceklerdir.
Kaynaklar:
1- Lumen Learning, “Thomson’s Atomic Model”. <https://courses.lumenlearning.com/cheminter/chapter/thomsons-atomic-model/>.
2- Toppr, “Thomson’s Model of an Atom”. <https://www.toppr.com/guides/chemistry/structure-of-atom/thomsons-model-of-an-atom/>
3- Byjus, “Thomson Atomic Model”. <https://byjus.com/chemistry/thomsons-model/>.
4- Universe today, “What Is The Plum Pudding Atomic Model?. <https://www.universetoday.com/38326/plum-pudding-model/>


