Dalton Atom Modeli ya da daha genel bir ifadeyle bütün maddelerin “atom” denilen küçük, bölünemez yapılardan oluştuğunu ifade eden model, atomun yapısına ilişkin deney ve gözleme dayanarak ortaya atılan ilk atom teorisidir.
Ancak Dalton Atom Modeli evrendeki her şeyin atomlardan oluştuğunu ortaya koyan tarihteki ilk teori değildir. Atom teorisinin kökeni antik dönemlere kadar gitmektedir.
Maddenin temel yapı taşlarının atomlar olduğunu ifade eden atom teorisinin binlerce yıl önce Antik Yunan’da, ünlü filozof Democritus ile birlikte ortaya çıktığına şahit oluyoruz.
Ancak Democritus bizzat gözlem yaparak atomların varlığını kanıtlamamış, daha ziyade teorik bir kavram olarak atom fikrini ortaya atmıştı. Demokritos Atom Modeli olarak da bilinen bu atom modeli hakkında daha fazla bilgi almak için dilerseniz buradaki yazımızı okuyabilirsiniz.
19.yüzyıla kadar Democritus’un öne sürdüğü atom teorisi, kanıta dayalı bir yaklaşımın atom teorisini ortaya çıkarana kadar kabul görmemişti. Özellikle de Aristoteles ve taraftarları atomcu anlayışı sert bir dille eleştirerek karşı çıkıyordu.
Ancak 18 ve 19.yüzyıl, fizik ve kimya da dahil birçok bilimsel alanda daha önce yapılmamış keşiflerin, o zamana kadar hiç kanıtlanmamış bilimsel teorilerin ortaya çıktığı yüzyıllardı.
İşte 18.yüzyılda yaşamış bilim insanı John Dalton’da deney ve gözleme dayanarak daha önceden kanıtlanamamış bir teoriyi kanıtlamayı başaracaktı.

1766 yılında doğan İngiliz kimyager ve fizikçi John Dalton, sonradan Dalton Atom Modeli olarak bilinecek, modern fiziğin ve kimyanın mihenk taşlarından biri haline gelecek olan ünlü atom teorisini ortaya atmasına yol açan deneyler yapmaya başladı.
Atomların birbiriyle nasıl etkileştiğine yönelik bir model ortaya koymanın yanı sıra John Dalton ayrıca gazların iç yapısına ilişkin bir anlayış sergileyen kanunları formüle etmesiyle de bilinmektedir.
Zamanla bu kanunlar, atomların birbiriyle nasıl etkileştiği, atomların ağırlığı vs. hususunda Dalton’a birtakım öngörüler sağlayacaktır. Bu yüzden Dalton’un atom ile ilgili çalışmalarına geçmeden önce kısaca gazlar ile alakalı yaptığı deneylere bir bakalım.
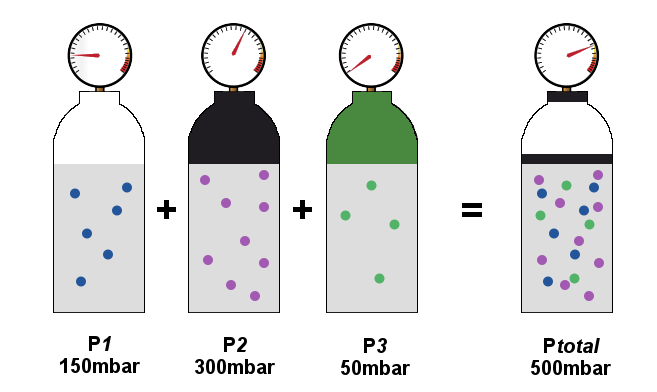
John Dalton’un gazlar ile ilgili çalışması 1800 yılında başlamıştı. Buhar basıncı ve farklı sıcaklıklardaki diğer gazlar da dahil birçok gazın oluşumu, buharlaşması ve gazların genleşmesi ile alakalı deneyler gerçekleştirerek, günümüzde Dalton Kanunu olarak bilinen yasaların temelini atmıştır.
Bu kanun, tepkimeye girmeyen gazların oluşturduğu bir karışımda, toplam basıncın gazların ayrı ayrı basınçlarının toplamına eşit olduğunu ifade etmekteydi.
Sabit Oranlar Yasası ve Kütle Korunumu Yasası
Gazlar ile ilgili çalışmaları doğrultusunda John Dalton, iki farklı gaz aynı ortak elementi ya da element gruplarını içerse bile belli gazların sadece belirli oranlarda karışabileceğini keşfetmişti.
Dalton’un yaptığı deneyler kimyasal tepkimelerle alakalı olan, 18.yüzyılın sonlarında ortaya çıkan iki teorinin ifade ettikleriyle tutarlılık gösteriyordu: Kütle Korunumu Yasası ve Sabit Oranlar Yasası.
Kütle Korunumu Yasası, 1789 yılında Antoine Lavoisier tarafından geliştirilip, kimyasal bir tepkimedeki toplam kütlenin değişmediğini ifade eder. Bir diğer ifadeyle tepkimeye girenler, ortaya çıkan ürünle aynı kütleye sahip olacaktır.
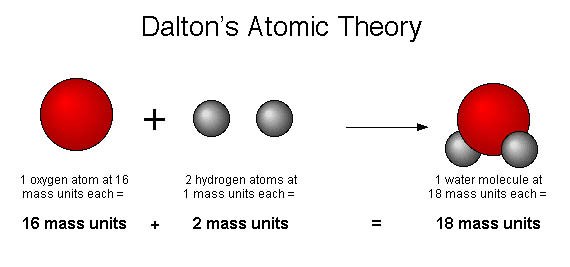
İkinci yasa ise Sabit Oranlar Yasası olarak bilinir. İlk olarak Fransız kimyacı Joseph Louis Proust tarafından 1799 yılında kanıtlanan yasa kısaca şunu ifade eder: Eğer bir bileşik, kendisini oluşturan elementlerine ayrıldığı takdirde elementlerin kütleleri her zaman aynı orana sahip olacaktır.
Örneğin suyun 18 gramının 16 gramı oksijenden oluşurken 2 gramı hidrojenden oluşmaktadır. Ya da 9 gram su alınırsa 8 gramı oksijen, 1 gramı hidrojen olacaktır.
Dalton Atom Teorisi Nasıl Ortaya Çıktı? Katlı Oranlar Yasası
Yukarıda sözü edilen iki yasaya dayanarak Dalton, sonradan Katlı Oranlar Yasası olarak bilinecek olan yeni bir kavram ortaya attı. Katlı Oranlar Yasası’na göre iki element eğer farklı bileşikler oluşturmak üzere bir araya gelirse, bu bileşiklerdeki her iki elementin kütlelerinin oranı bir tam sayı olacaktır.
Örneğin karbon ve oksijen elementlerini ele alalım. Bu iki element birleştiği takdirde karbondioksit gibi bir gaz ortaya çıkabileceği gibi, karbonmonoksit gibi bir gaz türü de ortaya çıkarabilir.
44 gram karbondioksitte 12 gram karbon ve 32 gram oksijen bulunmaktadır. 28 gram karbonmonoksitte ise 12 gram karbon ve 16 gram oksijen vardır. Görüldüğü üzere her iki bileşikteki 12 gram karbon için sırasıyla 32 gram ve 16 gram oksijen mevcuttur. 32/16 = 2 olacağından her iki bileşikteki oksijenin oranları arasında 1:2 şeklinde bir orantı vardır.
Ya da iki farklı demir oksit örneğinde her 100 “birim” demir için birincisinde 28 birim oksijen, ikincisinde 42 birim oksijen vardır. 28 ve 42 sayıları 2:3 oranını temsil eder.
Örnekleri arttırmak adına üç adet nitrojen oksit bileşiğini ele alalım. Her üç bileşikte bulunan 140 “birim” nitrojen için sırasıyla 80, 160 ve 320 “birim” oksijen bulunur. Bu sayılar oksijen için 1:2:4 oranını temsil etmektedir.
Yukarıda verilen örneklerdeki kimyasal tepkimelerde elementler arasında görülen benzer oranlar, Dalton ve diğer kimyagerler tarafından tespit edilmişti. Bu oranlar, kimyasalların rastgele bir miktarda tepkimeye girmediklerini, fakat belirli bir oranda tepkimeye uğradıklarını gösteriyordu.
Bunun üzerine Dalton, her kimyasal elementin tek, bölünemez ve eşsiz “atomlardan” oluştuğunu öne sürerek ünlü Dalton Atom Modeli’ni ortaya atmıştır. Çünkü ancak atomlar varsa kimyasallar böyle bir orantıya uyarak tepkimeye girebilir, diye düşünüyordu Dalton.
Bu durumda Dalton Atom Modeli Katlı Oranlar Kanunu’nu açıklar mı sorusuna da evet yanıtını verebiliriz.
Dalton Atom Modeli Özellikleri ve Varsayımları
Dalton’a göre atomlar hiçbir kimyasal yolla değiştirilemez ya da yok edilemezdi. Ancak daha kompleks yapılar oluşturmak üzere birbirleriyle birleşebilirlerdi.
Dalton’un bu öngörüsü, bilimsel anlamda ilk atom teorisinin habercisiydi. Çünkü Dalton vardığı sonuca deney ve çıkarım ile ulaşmıştı.
John Dalton elementler ve kimyasallar ile ilgili çalışırken elde ettiği bulgulara dayanarak, atomlar ile ilgili beş tane özellik belirlemiştir. Bunları şu şekilde özetleyebiliriz:
- Elementler, atom denilen son derece küçük parçacıklardan oluşur.
- Atomlar bölünemez, yaratılamaz ve yok edilemezdir.
- Belirli bir elementin atomları boyut, kütle ve diğer özellikleri açısından birbirinin aynısıdır. Farklı elementlere ait atomlar ise bu özellikler açısından birbirinden farklılık gösterir.
- Kimyasal tepkimelerde atomlar birleşir, ayrılır ve yeniden düzene girer.
- Farklı elementlere ait atomlar, kimyasal bileşikler oluşturmak üzere tam sayı oranına uygun olarak birleşir.
Herhangi Bir Elementin Tüm Atomlarının Kütle ve Özellikleri Aynıdır
John Dalton, altın gibi herhangi bir elementin bütün atomlarının birbiriyle aynı olduğunu öne sürüyordu. Ayrıca bir elementin atomlarının diğer elementlerin atomlarından farklılık gösterdiğini de ifade ediyordu.
Örneğin sodyum elementinin atomları karbon elementinin atomlarından farklıdır. Günümüzde de bu önermenin genellikle doğru olduğunu söyleyebiliriz.
Dalton’un öne sürdüğü, her elementin kendine has atomları olduğu hipotezi, birbirinden farklı çok fazla sayıda atomun “doğanın basit bir yapıda olduğu ilkesini” yok edeceğine inananlar açısından kabul etmesi zor bir yaklaşımdı. Fakat Dalton, önerisine karşı yapılan itirazları gerçek dışı buluyordu.
Farklı Elementlere Ait Atomların Kütleleri de Birbirinden Farklıdır
Her elementin atomlarının birbirinden farklı olduğu gerçeğinden çıkan bir diğer sonuç da farklı elementlere ait atomların ağırlıklarının da farklı olduğudur.
Böylelikle Dalton da suyun farklı oranlarda farklı gazlar özümsediğini işte bu sonuca, farklı elementlerin atomlarının farklı ağırlıklara sahip olduğu sonucuna bağlıyordu.
Örneğin su, karbon dioksiti, nitrojeni özümsediğinden çok daha iyi özümsüyordu. Dalton bunun, atomların kütlelerindeki farklılıktan kaynaklandığını öne sürmüştü. Aslına bakılacak olursa gerçekten de karbon dioksit molekülleri nitrojen moleküllerinden daha ağır ve büyüktür.
Buna ek olarak Dalton’un, atomların var olabileceğine ilişkin ilk hipotezi, yukarıdaki gözlemi yaparak ortaya attığı söylenir. Sudaki gazların emilimine ilişkin 1805 tarihli makalesinde, Dalton şöyle yazıyordu:
Su neden her gaz çeşidini aynı şekilde özümsemiyor? Bu soru üzerine yeterince düşündüm ve her ne kadar kendimi tam anlamıyla ikna edemesem de bu fenomenin, farklı gazların temel parçacıklarının sayısı ve ağırlığına bağlı olduğuna neredeyse eminim.
John Dalton
Böylelikle Dalton, her farklı atomun birbirilerine göre kütlelerini belirlemek üzere çalışmalara başladı. Bunu ise yalnızca farklı kimyasal bileşiklerdeki her elementin atom sayılarını göz önünde bulundurarak gerçekleştirilebilirdi.
Atomlarla ilgili çalışmalarını sürdüren Dalton hidrojen, oksijen, nitrojen, karbon, sülfür ve fosfor olmak üzere altı elementi içeren, atomların birbirlerine göre ağırlıklarını veren ilk tablosunu yayınlamıştı.
Kütle açısından referans atomu hidrojen olarak belirleyen Dalton, hidrojenin kütle numarasını 1 olarak belirleyerek diğer atomların ağırlıklarını da bu elemente göre belirlemişti.

Ortaya attığı atom teorisine ilişkin 1808 yılında yayınladığı ilk kapsamlı makalede Dalton, ek bir öneri de ileri sürüyordu: “Basitlik Kuralı”.
Bu kurala göre iki farklı elemente ait atomlar eğer tek bir bileşik oluşturacak olursa, örneğin suyu oluşturan hidrojen ve oksijen gibi ya da amonyak oluşturan hidrojen ve nitrojen gibi, o bileşiğin moleküllerinin her elementten bir atom içermesi gerekiyordu.
Örneğin Dalton, H2O olarak bildiğimiz su molekülünün, HO olduğunu, yani bir hidrojen ve bir oksijen atomundan meydana geldiğini sanmaktaydı. Dalton, doğanın basitliği ilkesine inandığından bu sadece bir varsayımdı.
O zamanlar bir bileşiğin her elementten ne kadar atom içermesi gerektiğine yönelik bilim insanlarının elinde bir kanıt mevcut değildi. Ancak Dalton’un, atomların göreli ağırlıklarını hesaplayabilmesi için böyle bir varsayımda bulunması gerektiğini söyleyebiliriz.
Dalton Atom Modeli Kütle Korunumu Kanunu ile Uyum Gösteriyor Mu?
Dalton, kimyasal tepkimelerin atomları oluşturmadığı ya da yok etmediğini öne sürüyordu. Örneğin sodyum, tuz oluşturmak üzere klor ile tepkimeye girdiği zaman hem sodyum hem de klor atomları varlığını sürdürüyordu. Meydana gelen şey ise sadece yeni bir bileşik idi.
Dalton Atom Modeli atomların yaratılıp yok edilemeyeceğini öne sürdüğü için, kimyasal bir tepkimedeki tepkimeye giren atomların net kütlesinin korunduğunu ifade eder. Böylelikle model de kütle korunumu kanunu ile uyumluluk göstermektedir.
Dalton Atom Modeli Eksiklikleri ve Yanlışları
Dalton Atom Modeli her ne kadar modern atom teorisiyle oldukça ortak yönlere sahip olsa da bazı eksiklikleri bulunmaktadır. Bunlar:
- Dalton Atom Modeli atom altı parçacıklarının varlığını hesaba katmamıştı. Çünkü model, atomların bölünemez olduğunu iddia ediyordu.
- Bir elementin bütün atomlarının aynı kütle ve boya sahip olduğunu öne süren bu model, atomların izotoplarını hesaba katmamıştı. İzotoplar Dalton’dan sonra keşfedilen, aynı elemente ait fakat farklı sayıda nötron içeren atomlardır. İzotoplar, farklı sayıda nötron içerdikleri için kütleleri de birbirinden farklılık göstermektedir.
- Dalton Atom Modeli, bir elementin farklı allotroplarının (farklı diziliş biçimlerinin) özelliklerindeki farklılıkları açıklayamıyordu.
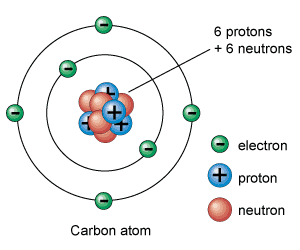
Dalton Atom Modeli atomların bölünemez ve maddenin en küçük yapı taşları olduğunu iddia ediyordu. Ancak 20.yüzyılda yapılan keşif ve deneylerle birlikte atomun daha temel parçacıklardan, yani elektron, proton ve nötrondan oluştuğu ortaya çıkmıştı.
Dalton’un yaşadığı dönemde henüz atom altı parçacıklar keşfedilmediği için de Dalton Atom Modeli’nin atom yapısında elektronların, protonların ve nötronların bulunmadığını ifade edebiliriz.
Dalton ise atomların herhangi bir elektrik yüküne sahip olmadığını düşünüyor ve atomları tek bir varlık olarak görüyordu. J.J. Thomson, Ernest Rutherford ve Neils Bohr gibi fizikçiler tarafından sonradan yapılacak olan çalışmalar ise daha doğru bir atom modelinin ortaya çıkmasına zemin hazırlayacaktı.
Ancak Dalton’un, modern atom teorisinin yüzyıllar boyunca gelişimi sürecinde yaptığı katkılar sayesinde, atom kütlesi biriminin ismi Dalton olarak belirlenmiştir.
Netice itibariyle Dalton, atom ile ilgili yaptığı çalışmaların sonucuna deney ve gözlem ile ulaştığı için Dalton Atom Modeli’nin, atomun ne olduğu ile alakalı geliştirilen ilk bilimsel teori olarak görüldüğünü söyleyebiliriz.
- Khan Academy, "Dalton's atomic theory (article)
- Lumen Learning Courses, "John Dalton and Atomic Theory
- Britannica, "John Dalton - Atomic theory
- Wikipedia, "Atomic theory
- Wikipedia, "John Dalton
- Byju's, "Dalton's Atomic Theory
- Universe Today, "What Is John Dalton's Atomic Model?
- Vikipedi, "Sabit oranlar yasası
- Vikipedi, "Katlı oranlar yasası