Bohr Atom Modeli, negatif yüklü elektronların pozitif yüklü çekirdeğin etrafında, tıpkı gezegenlerin Güneş’in etrafında dönmesine benzer bir şekilde dönmesini tasvir eden bir modeldir.
Gezegenlerin Güneş etrafında dönmesini sağlayan kuvvet kütleçekimi kuvveti iken, Bohr Atom Modeli’ne göre elektronları atom çekirdeğinin etrafında tutan kuvvet elektrostatik kuvvettir.
Bohr Atom Modeli her ne kadar bazı hatalar içerse de bilim tarihinde önemli bir yere sahip bir modeldir. Çünkü günümüzde atoma ilişkin elimizdeki güncel bilgilerimizin çoğunu başarılı bir şekilde açıklayabilmektedir.
Danimarkalı ünlü fizikçi Niels Bohr, 1915 yılında Bohr Atom Modeli’ni ortaya atmıştı. Bohr Atom Modeli, kendinden önce öne sürülen Rutherford Atom Modeli‘nin bir devamı niteliğinde olduğu için, bazı kimseler bu modeli Rutherford-Bohr Atom Modeli olarak da adlandırmaktadır.
Bohr Atom Modeli’nin Ortaya Çıkmasına Zemin Hazırlayan Şey
20.yüzyılın başlarında Ernest Rutherford, gerçekleştirdiği bir dizi deney sonucu atomun merkezinde bulunan küçük, yoğun ve pozitif yüklü çekirdeğin etrafında negatif yüklü elektron bulutlarının mevcut olduğunu keşfetmişti.
Bu deneysel veriler sonucunda Rutherford, gezegenlerin Güneş etrafında dönmesi benzetmesini kullanarak, elektronların atom çekirdeğinin etrafında döndüğünü ifade eden Rutherford Atom Modeli’ni ortaya atmıştı.
Ancak bu modelin bir sorunu bulunuyordu. Pozitif yüklü atom çekirdeğinin etrafında dönen negatif yüklü elektronlar, klasik fiziğin kanunlarına göre elektromanyetik radyasyon yaymalıydı.
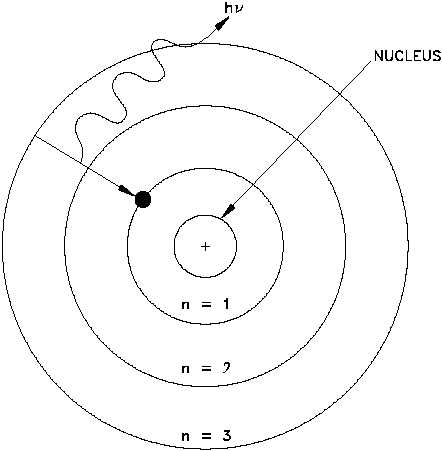
Elektromanyetik radyasyon yayan elektron, enerji kaybedeceği için çekirdek etrafında hızlı bir şekilde sarmal çizerek düşmesi gerekirdi. Öyle ki bu düşmenin gerçekleşme süresi hesaplamalara göre sadece pikosaniyeler ölçeğinde sürecekti.
Görüleceği üzere bu atom modeli tam bir felaket senaryosuna benziyordu. Çünkü elektronların çekirdeğe düşmesi demek, atomların şu anki mevcut halini koruyamaması anlamına gelmekteydi.
Ancak model ile gözlemler tam bir tezatlık gösteriyordu. Çünkü atomlar kararsız bir yapıda olsaydı etrafımızdaki hiçbir maddeyi şuanda olduğu gibi göremezdik.
Ayrıca Rutherford Atom Modeli’ne göre elektronlar sarmal çizerek çekirdeğe doğru düştükçe, yaydığı elektromanyetik radyasyonun frekansı, yörünge süresinin azalmasına bağlı olarak hızlı bir şekilde artacaktı.
Rutherford Atom modeli ile gözlemler arasındaki bu tutarsızlığı ortadan kaldıracak olan kişi, kuantum fiziğinin öncülerinden Danimarkalı fizikçi Niels Bohr olacaktır.
Bohr Atom Modeli Nasıl Ortaya Çıktı?
Bohr, öncelikle klasik fiziğin kurallarına göre tasarlanan bu atom modelinin, atomun kararlı yapısını asla açıklayamadığını fark etmişti. Bohr’a göre kararlı bir atom, belirli bir boyuta sahiptir. Böylelikle atomu tanımlayan her denklem ya da model, birtakım temel sabitleri içermeliydi.

Niels Bohr’un böyle bir çıkarım yapmasına sebep olan ise bir diğer ünlü fizikçi Max Planck idi. Max Planck, ısınan cisimlerden yayılan elektromanyetik radyasyonu formüle eden ünlü “Planck Sabiti” kavramını 1900 yılında tanıtmıştı.
Planck’tan önce mevcut olan elektronmanyetik radyasyon ile ilgili teorilere göre, ışığın bütün frekanslarda üretilebilmesi mümkündü.
Bu teori sadece gözlemlerle çelişmiyor, ayrıca ısınan bir cismin yaydığı toplam enerjinin sonsuz olması gerektiği şeklinde imkansız bir sonuç ortaya çıkıyordu.
Bunun üzerine Planck, yayılan elektromanyetik radyasyonun ya da enerjinin sadece belirli miktarlarda, paketçikler halinde yayılabileceğini ya da emilebileceğini öne sürdü.
Bu enerji paketçiklerini de “kuanta” olarak adlandırıyordu. Kuanta, Latince miktar ifade eden “ne kadar” kelimesinin bir karşılığıydı.
Planck, elektromanyetik radyasyonun sadece belli miktarda enerji paketçikleri halinde yayıldığını öne sürmesinden sonra Bohr, atom çekirdeğinin etrafında dönüp elektromanyetik radyasyon yayan elektronların durumuna bir açıklık getirecekti.
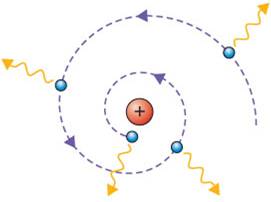
Elektronun enerji yayması, sadece elektron bir yörüngeden diğerine “zıpladığı” zaman gerçekleşecekti.
Bohr’a göre bir elektronun enerjisi, çekirdeğin etrafında bulunduğu yörüngenin boyutuna bağlıydı. Eğer çekirdeğe yakın bir yörüngede bulunuyorsa, enerjisi de küçük olacaktı.
Böylelikle atom kararlı yapısını tamamen korumuş olacak, klasik fiziğin söylediğinin aksine elektronlar sonsuza kadar enerji yaymak zorunda kalmayacaktı.
Çünkü en düşük yörüngede bulunan elektronun zıplayabileceği daha küçük bir yörünge bulunmuyordu.
Bohr Atom Modeli Özellikleri
Planck’ın bulduğu sabiti kullanarak Bohr, hidrojen atomunun enerji seviyesine ilişkin kesin bir formül geliştirmişti. Özetleyecek olursak eğer, çekirdeğin etrafında dönen elektronların açısal momentumu ya da bir diğer ifadeyle enerji seviyeleri Planck Sabiti’nin tam sayı katlarına(n = 1,2,3) eşittir.
Bu enerji seviyelerini temsil eden sayılar, “kuantum sayıları” olarak bilinmektedir. Kuantum sayıları için en düşük değer 1 olup mümkün olan en küçük yörünge yarıçapına karşılık gelmektedir. Bu çap, 0.0529 nanometreye karşılık gelmekle birlikte “Bohr Yarıçapı” olarak da adlandırılır.
Bir elektron, en düşük yörünge seviyesinde olduğu zaman artık protona daha fazla yaklaşamaz. Kuantum sayılarının enerji seviyelerini belirlediği gerçeğinden yola çıkan Bohr, hidrojen atomlarının izin verilen yörünge enerjilerini hesaplayabilmişti.
Bu yörüngelerde elektronların çekirdek etrafındaki ivmeli hareketleri, elektromanyetik radyasyon ve dolayısıyla enerji yayılımıyla sonuçlanmıyordu. Kısacası Bohr Atom Modeli, ivmelenen elektronların enerji kaybına uğramadığını ifade etmekteydi.
Bohr Atom Modeli, elektronların bir yörüngeden diğerine “zıplarken”, sadece belirli miktarlarda(kuantalarda) enerji emdiğini ya da yaydığını söylüyordu.
Örneğin, bir elektron eğer çekirdeğe yakın bir yörüngeye “zıpladığı” takdirde, iki yörüngenin enerjileri arasındaki farka eşit bir enerji yayması gerekiyordu.
Tersine, elektron daha büyük bir yörüngeye geçtiği zaman ise yörüngeler arasındaki enerjine farkına eşit miktarda enerji paketçiği emmeliydi.
Ancak elektronlar, yörünge değiştirmeden bulunduğu yörüngelerde dolanmaya devam ettikleri sürece herhangi bir elektromanyetik radyasyon, yani enerji yaymayacaklardı.
Bohr Atom Modeli, elektronun, eğer çekirdekten uzakta bulunursa daha fazla enerjiye, çekirdeğe yakın durduğu zaman ise daha az enerjiye sahip olacağını ifade etmekteydi.
Bohr Atom Modeli Eksiklikleri
Bohr Atom Modeli her ne kadar kendinden önceki atom modellerine göre daha doğru ve kesin bir atom modeli ortaya koysa da o da bazı eksikliklere sahipti. Bunlar:
- Bohr Atom Modeli hem klasik hem de kuantum fiziğinin özelliklerini taşımaktaydı. Örneğin elektronun çekirdek etrafındaki dairesel hareketi klasik fiziğe göre modellenirken, elektronun enerjisi kuantum fiziği kurallarına göre formüle ediliyordu.
- Yörüngelerde ivmelenen elektronların neden elektromanyetik radyasyon yaymadığı hususunu Bohr Atom Modeli açıklamakta yetersiz kalmaktaydı.
- Tayf çizgilerinin birbirine göre yoğunluğu açıklanamıyordu. Bazı renk tayfları diğerlerinden daha parlak gözükmekteydi.
- Bohr Atom Modeli, hidrojenden daha büyük atomların yapısını da açıklamakta başarısız olmuştu. Bu model, en dış yörüngede sadece bir elektronu bulunan atomları ya da iyonları açıklayabiliyordu. Ancak bir atomdaki proton sayısı arttıkça Bohr Atom Modeli’nin tahmin gücü de o oranda azalmaktaydı.
- Ayrıca Bohr Atom Modeli, Heisenberg Belirsizlik İlkesi’ni de ihlal ediyordu. Çünkü bu model, elektronların belli bir yarıçapa ve yörüngeye sahip olduğunu ifade etmekteydi.
- Toppr, "Bohr's Model of Atom
- Wikipedia, "Bohr model".
- Abyss, "Bohr Atomic Model